
Anatomía y función del cerebro – El cerebro se divide desde la parte frontal hasta la parte posterior en dos mitades llamadas hemisferios cerebrales. Cada hemisferio se divide en cuatro lóbulos: frontal, parietal, occipital y temporal. Los tumores de cerebro que están en los lóbulos se llaman supratentoriales; los tumores que están en el cerebelo o el tallo del encéfalo se llaman infratentoriales. 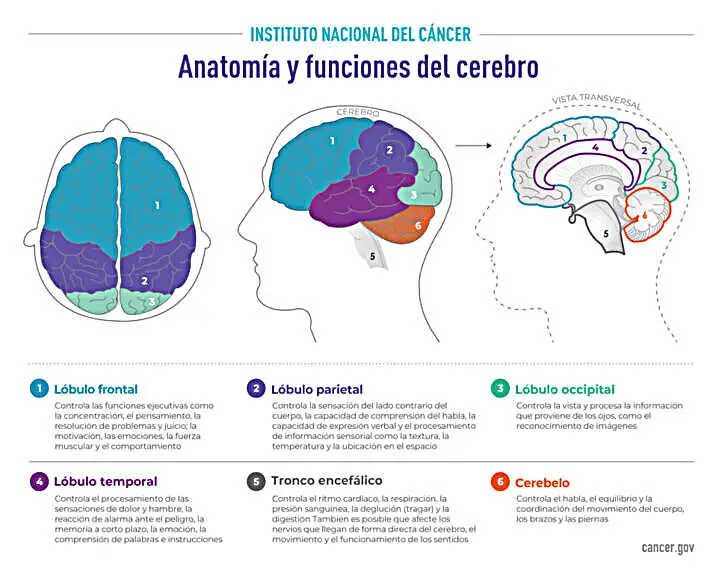
¿Qué es supra o infratentorial?
| Title: | Brain, Medial, Child, Anatomy-HP – Spanish |
|---|---|
| Description: | Dibujo del interior del encéfalo que muestra la región supratentorial (la porción superior del encéfalo) y la fosa posterior o región infratentorial (la porción inferior y posterior del encéfalo). La región supratentorial contiene el cerebro, un ventrículo lateral, el tercer ventrículo, el plexo coroideo, el hipotálamo, la glándula pineal, la hipófisis y un nervio óptico. La fosa posterior o región infratentorial contiene el cerebelo, la tienda del cerebelo, el cuarto ventrículo y el tronco encefálico (protuberancia y bulbo raquídeo). También se muestra el techo del mesencéfalo y la médula espinal. La región supratentorial (la porción superior del encéfalo) contiene el cerebro, un ventrículo lateral y el tercer ventrículo (con el líquido cefalorraquídeo en color azul), el plexo coroideo, el hipotálamo, la glándula pineal, la hipófisis y un nervio óptico. La fosa posterior o región infratentorial (la porción inferior y posterior del encéfalo) contiene el cerebelo, el techo del mesencéfalo, el cuarto ventrículo y el tronco encefálico (protuberancia y bulbo raquídeo). This image is part of the Ilustraciones Médicas en Español (Spanish) collection. |
| Topics/Categories: | Anatomy – Nervous System Español – Fotografías e Ilustraciones Médicas People – Child |
| Type: | Color, Medical Illustration (JPEG format) |
| Source: | National Cancer Institute |
| Creator: | Terese Winslow (Illustrator) |
| AV Number: | CDR749327 |
| Date Created: | November 10, 2015 |
| Date Added: | November 25, 2013 |
| Reuse Restrictions: | Yes – This image is copyright protected. Any use of this image is subject to prevailing copyright laws.U.S. Government has reuse rights. Please contact the rights holder of this image for permission requests. Rights holder: Terese Winslow Email: [email protected] |
¿Qué es una lesión infratentorial?
Documento de consenso Recomendaciones para la utilización e interpretación de los estudios de resonancia magnética en la esclerosis múltiple Recommendations for using and interpreting magnetic resonance imaging in multiple sclerosis A. Rovira a, b, Autor para correspondencia, M.
Tintoré a, c, J.C. Álvarez-Cermeño a, d, G. Izquierdo a, e, J.M. Prieto a, f a Grupo de enfermedades desmielinizantes de la Sociedad Española de Neurología (SEN), Red Española de Esclerosis Múltiple (REEM) b Unitat de Ressonància Magnètica (IDI), Servei de Radiología, Hospital Universitario Vall d’Hebron, Barcelona, España c Unitat de Neuroimmunologia Clínica, Centre d’Esclerosi Multiple de Catalunya (CEM-Cat), Hospital Universitario Vall d’Hebron, Barcelona, España d Servicio de Neurología, Hospital Ramón y Cajal, Madrid, España e Unidad de Esclerosis Múltiple, Hospital Universitario Virgen Macarena, Sevilla, España f Servicio de Neurología, Complexo Hospitalario Universitario de Santiago de Compostela, A Coruña, España Este artículo ha recibido Resumen Objetivo Establecer unas recomendaciones para utilizar e interpretar la resonancia magnética (RM) en el diagnóstico y el seguimiento de la esclerosis múltiple (EM).
Método Basados en una extensa revisión de la literatura y en su propia experiencia personal, un grupo de expertos en EM consensuaron unas recomendaciones con este objetivo. Resultados Siempre que sea posible se debe practicar un estudio de RM craneal en el diagnóstico o la evaluación inicial de los pacientes con sospecha de EM.
- Un estudio de RM espinal debe realizarse en todo paciente cuyo inicio clínico es un síndrome medular, cuando los hallazgos de la RM cerebral sean poco específicos o cuando el estudio de RM cerebral sea normal en pacientes diagnosticados clínicamente de EM.
- Los estudios cerebrales deben efectuarse con técnicas de reposicionamiento adecuadas y combinando secuencias ponderadas en densidad protónica, T2 y fast- FLAIR,
Es obligado utilizar contraste siempre que se pretenda determinar diseminación temporal o espacial de las lesiones desmielinizantes para el diagnóstico inicial, o para determinar actividad inflamatoria o progresión lesional en los estudios de seguimiento.
Conclusiones Disponer de unas recomendaciones para la utilización y la interpretación de los estudios de RM en el diagnóstico y el seguimiento de los pacientes con EM debe servir para racionalizar los recursos y para optimizar los resultados clínicos derivados de su práctica. Palabras clave: Esclerosis múltiple Resonancia magnética Recomendaciones Abstract Objective To establish recommendations for using and interpreting magnetic resonance imaging (MRI) results in the diagnosis and follow up of multiple sclerosis (MS).
Method Based on an extensive review of the literature and on their own experience, an expert group on MS produced a consensus on recommendations for using and interpreting MRI results in the diagnosis and follow up MS. Results A brain MRI must be performed whenever possible in the initial diagnosis and assessment of patients suspected with MS.
- A spinal MRI study should be performed on all patients whose clinical onset shows signs of spinal cord syndrome, when the brain MRI findings are not very specific or when the brain MRI is normal in patients diagnosed clinically with MS.
- Cranial studies should be performed using appropriate repositioning techniques and different MR sequences, such as proton-density and T2-weighted fast spin-echo, and Fast-FLAIR.
The use of contrast is mandatory whenever attempting to determine the temporal and spatial dissemination of demyelinating lesions for the initial diagnosis, or to determine inflammatory activity or lesion progression in follow up studies. Conclusions The use of recommendations for using and interpreting MRI results in the diagnosis and follow up MS should help to rationalise resources and optimise the clinical results arising from its practice.
- Eywords: Multiple sclerosis Magnetic resonance imaging Recommendations Texto completo Introducción La resonancia magnética (RM) es la técnica más sensible en la detección de lesiones desmielinizantes en el sistema nervioso central (SNC) en pacientes con esclerosis múltiple (EM) 1,
- Como consecuencia de esta alta sensibilidad, la RM se ha convertido en una técnica esencial no sólo en el diagnóstico de la EM, sino también como marcador pronóstico en la fase inicial de la enfermedad, tanto en relación con la frecuencia y la gravedad de futuras recurrencias clínicas como con el grado de discapacidad futura 2,3,
Además, la RM contribuye de forma relevante a una mejor comprensión de su historia natural y a la valoración de la eficacia de nuevos tratamientos 4,5, Los nuevos criterios diagnósticos propuestos por McDonald et al 6 dan gran relevancia a los hallazgos de los estudios de RM, ya que se admite la posibilidad de establecer el diagnóstico de EM en pacientes con un único episodio clínico cuando se demuestra por RM las lesiones desmielinizantes en el SNC diseminadas en espacio y tiempo.
La introducción en los últimos años de terapias que modifican el curso de la enfermedad, especialmente desde sus etapas más iniciales, hace preciso establecer unas recomendaciones sobre la forma de utilizar e interpretar la RM de manera eficaz no sólo en el diagnóstico inicial de la enfermedad, sino también en su seguimiento 5,
Las recomendaciones establecidas en este documento están dirigidas a la práctica asistencial y no a estudios de investigación o a ensayos clínicos en los que las técnicas a utilizar y los tipos de análisis a realizar son diferentes 7,8, RM en pacientes con un primer episodio clínico de probable origen desmielinizante Una RM cerebral debe obtenerse en todo paciente con un cuadro clínico indicativo de corresponder a un primer brote de origen desmielinizante.
En esta situación la RM debe realizarse con carácter preferente, y siempre que sea posible, antes de iniciar el tratamiento corticoideo, ya que éste suprime temporalmente el realce con el contraste de las lesiones activas 9, El objeto de este estudio inicial es identificar las lesiones desmielinizantes en el SNC y definir sus características (topográficas, morfológicas y numéricas), así como descartar lesiones de origen no desmielinizante causales del cuadro clínico.
A pesar de que la RM orbitaria tiene una elevada sensibilidad en detectar la afección del nervio óptico en la fase aguda de una neuritis óptica, esta exploración no se considera necesaria para confirmar este diagnóstico, a menos se produzcan hallazgos clínicos atípicos o persistentes, en cuyo caso la RM tiene como objeto principal descartar procesos causales de origen no desmielinizante 10,
En pacientes en que el cuadro se inicia con un síndrome medular, debe realizarse, además del estudio de RM cerebral, una RM medular con el objeto de confirmar la lesión desmielinizante sintomática y descartar lesiones causales de otro origen. La RM medular (especialmente del segmento cervical) también está indicada cuando los hallazgos de la RM cerebral no sean concluyentes.
Recomendaciones para el uso de la RM en formas remitentes-recurrentes de EM En la EM remitente-recurrente (EMRR), en la que los pacientes han presentado brotes en diferentes topografías y momentos, teóricamente no sería necesario confirmar el diagnóstico mediante RM.
- Sin embargo, en nuestro entorno, donde el acceso a la RM es fácil, se hace discutible establecer un diagnóstico de EM sin el apoyo de un estudio de RM compatible.
- Por ello, para confirmar el diagnóstico clínico de EM, es altamente aconsejable practicar un estudio de RM cerebral en todos los pacientes.
Además, los estudios craneales deben complementarse con un estudio medular en los siguientes supuestos:
1. Pacientes diagnosticados clínicamente de EM y en los que el estudio de RM cerebral sea normal. En estos casos la detección de lesiones subclínicas en la médula espinal de características desmielinizantes apoyaría el diagnóstico clínico 11, 2. Pacientes con sospecha clínica de EM en los que los hallazgos de la RM cerebral no sean concluyentes para poder confirmar este diagnóstico. En este supuesto, la identificación de lesiones subclínicas en la médula espinal de características desmielinizantes apoyaría el diagnóstico de EM 12,
RM en EM primaria progresiva Es indispensable practicar un estudio de RM cerebral y medular a todo paciente diagnosticado clínicamente de EM primaria progresiva (EMPP) en caso de no disponer de una exploración reciente, con el objeto de excluir procesos que pudieran causar un cuadro de discapacidad progresiva (tumor intrarraquídeo, fístula dural espinal, etc.) y confirmar si hay lesiones desmielinizantes.
- La presencia de lesiones desmielinizantes cerebrales y medulares forma parte de los criterios diagnósticos en esta forma clínica de EM 6,13,14,
- Recomendaciones técnicas para la adquisición de los estudios de RM en EM Los estudios deben efectuarse preferentemente en equipos de alto campo (1,5 T-3,0 T) si bien son aceptables los de campo medio (1,0 T).
En los estudios cerebrales, las secuencias rápidas ( fast /turbo) para la obtención de imágenes ponderadas en densidad protónica (DP) y T2 (también llamadas secuencias T2 de doble eco ) son preferibles a las secuencias spin echo de convencionales 15,
- Ello se explica por la menor duración en la adquisición de las primeras, lo cual minimiza los artefactos de movimiento.
- Las secuencias fast- FLAIR pueden utilizarse de forma complementaria a las secuencias T2 y, en general, es recomendable obtenerlas en el plano sagital y transversal por su alta sensibilidad en la detección de lesiones en el cuerpo calloso y yuxtacorticales 16 ( figs.1 y 2 ).
Si bien algunos estudios han demostrado una mayor sensibilidad de la secuencia fast- FLAIR en comparación con las secuencias T2 de doble eco en la detección de lesiones supratentoriales, ésta es claramente inferior en la detección de lesiones infratentoriales ( fig.3 ) y medulares.
- Por lo tanto, no es recomendable utilizar esta secuencia como sustituto de la secuencia T2 de doble eco 17,
- Una estrategia que ofrece una máxima sensibilidad en un tiempo razonable es la combinación de secuencias fast -T2 de doble eco y fast- FLAIR 18,
- En los estudios medulares las secuencias spin echo convencionales de doble eco ponderadas en T2 son las más sensibles en la detección de lesiones focales en el plano sagital.
Sin embargo, los artefactos producidos por el movimiento pulsátil del líquido cefalorraquídeo (LCR) y de la propia médula espinal obligan a obtener estas secuencias sincronizadas con el ciclo cardíaco o con el pulso periférico, lo que conlleva tiempos de adquisición excesivamente largos.
La utilización de secuencias fast ponderadas en densidad protónica y T2, si bien parecen ser menos sensibles, son más rápidas, no precisan sincronización cardíaca o con el pulso periférico y son de suficiente calidad diagnóstica en un porcentaje mayor de casos 19,20 ( fig.4 ). Si bien algunos estudios han mostrado una mayor sensibilidad de las secuencias STIR en la detección de lesiones medulares, estas secuencias inducen con frecuencia artefactos que son causa de falsos positivos, por lo que no se recomienda su uso de forma aislada.
Las imágenes obtenidas en el plano transversal deben ser de alta resolución (tamaño de vóxel, 3 × 1 × 1 mm). Para reducir los artefactos derivados de la pulsación del LCR es recomendable, en la obtención de imágenes transversales, utilizar secuencias en eco de gradiente con un tiempo de eco corto en el segmento cervical, si bien es aceptable utilizar secuencias fast ponderadas en T2 20,
En el segmento medular dorsal las imágenes transversales deben adquirirse con secuencias fast ponderadas en T2 con eco largo. Los estudios medulares se benefician de la utilización de bobinas phase-array de columna 21, que permiten obtener imágenes completas del cordón medular con una única secuencia.
La resolución en plano de las imágenes obtenidas en los estudios cerebral debe ser isotrópica (1 × 1 mm) y el grosor entre 3 y 5 mm (sin separación). Los cortes obtenidos deben abarcar todo el parénquima encefálico, para lo que se requieren aproximadamente 24 si se utilizan cortes con un grosor de 5 mm y 42 cuando son de 3 mm.
La adquisición de cortes con un grosor de 5 mm permite obtener estudios en tiempos relativamente cortos y probablemente sea la estrategia a utilizar en la mayoría de las situaciones. La obtención de estudios con cortes contiguos de 3 mm incrementa la sensibilidad en la detección de lesiones de pequeño tamaño, reduce el impacto del efecto de volumen parcial, facilita el corregistro entre diferentes secuencias y su análisis cuantitativo, pero incrementa el tiempo de examen y disminuye la relación señal/ruido de las imágenes obtenidas.
Este aumento de la sensibilidad en la detección de lesiones con la utilización de cortes de 3 mm no ha demostrado impacto significativo en el diagnóstico de la enfermedad. Por lo tanto, la decisión de utilizar cortes de 3 o 5 mm dependerá del tipo de análisis que se realice de las imágenes obtenidas, si bien es recomendable utilizar cortes de 3 mm en estudios que forman parte de estudios seriados que van a ser analizados de forma cuantitativa (volumen lesional).
- En todo caso, el diagnóstico y el seguimiento de un paciente deben realizarse, siempre que sea posible, con las mismas características 7,22,
- Protocolos recomendados Los protocolos recomendados para los estudios cerebrales y medulares en el diagnóstico inicial y de seguimiento varían en función de las marcas y los campos de los equipos de RM.
A modo aproximativo, las tablas 1 y 2 recogen secuencias y parámetros técnicos más aconsejables en equipos de 1,5 T, que son los más utilizados en la práctica clínica habitual. Reposicionamiento de los estudios de RM cerebrales La demostración de los cambios temporales de las lesiones desmielinizantes (diseminación temporal en pacientes con sospecha diagnóstica de EM, y progresión en número y tamaño de las lesiones en pacientes con EM) puede realizarse mediante estudios seriados de RM cerebral.
El análisis visual o automático de los cambios en el número y el volumen de estas lesiones puede verse enormemente dificultado por diferencias en el posicionamiento de los cortes tomográficos obtenidos entre los estudios de RM a comparar. Pequeñas variaciones en el reposicionamiento de los cortes pueden dificultar la detección visual de lesiones nuevas o aumentadas de tamaño e inducir grandes variaciones en la cuantificación del volumen lesional que pueden superar su variación esperada en un año 23,
Por lo tanto, es esencial utilizar una técnica de reposicionamiento reproducible y sencilla que incluso permita comparar estudios de RM craneal obtenidos en centros diferentes. La técnica de reposicionamiento más utilizada es la descrita por Gallagher et al 24, que precisa como único prerrequisito la posibilidad de obtener planos tomográficos en doble oblicuidad.
- La utilización de cortes de 3 mm y de elementos de fijación de la cabeza durante el examen contribuye a facilitar el reposicionamiento de los estudios y, por lo tanto, a minimizar los errores de cuantificación lesional 25,
- La técnica de corregistro entre secuencias obtenidas en tiempos diferentes es una buena estrategia para evitar errores derivados de un mal posicionamiento 26,
Administración de contraste La utilización de secuencias potenciadas en T1 en combinación con la inyección de contraste paramagnético (compuestos que contienen gadolinio) permite identificar de forma selectiva las lesiones con actividad inflamatoria 4 a partir del realce (hiperseñal) que muestran.
- Este realce parece ser un acontecimiento constante y precoz en las lesiones de EM, y puede adoptar diferentes formas 27 (nodular, anillo completo, anillo incompleto) ( fig.5 ) que dependerán de la localización en la placa desmielinizante de las zonas con actividad inflamatoria.
- Un realce en anillo incompleto es un signo muy específico de lesiones desmielinizantes, que es de gran ayuda para diferenciar lesiones desmielinizantes seudotumorales de lesiones tumorales o infecciosas.
Los segmentos de la periferia de la lesión en los que no hay realce coinciden con el margen de la lesión que contacta con la sustancia gris, donde hay menor grado de reacción inflamatoria. El realce con el contraste de las lesiones agudas es reversible y tiene una duración media de 3 semanas, si bien en un 3% de los casos es de más de 2 meses 28,
En ocasiones este realce puede reaparecer en la periferia de lesiones crónicas reactivadas. La utilización de secuencias con contraste tiene relevancia en el diagnóstico inicial de la enfermedad para demostrar diseminación tanto espacial como temporal de las lesiones desmielinizantes 6, También tiene relevancia en los estudios de seguimiento que pretenden valorar el grado de actividad inflamatoria y progresión lesional 3,
Guía para la identificación de lesiones que realzan con contraste 29 Una lesión que se realza con contraste se define como un área de incremento de señal evidente en secuencias T1 en relación con la misma área en una secuencia T1 de iguales características obtenida antes de la administración de contraste o, en caso de no disponer de ella, en relación con el tejido adyacente normal (con señal normal en secuencias T2).
- Focos de hiperseñal de pequeño tamaño (1 píxel) no deben considerarse como lesiones con realce, ya que en su mayoría corresponden a estructuras vasculares.
- Las lesiones que se realzan con el contraste se asocian, en prácticamente todos los casos, con focos de hiperseñal en las secuencias T2.
- Esta condición es obligada cuando se consideran lesiones en la fosa posterior y altamente recomendable a nivel supratentorial.
No es imprescindible esta condición en lesiones supratentoriales de localización corticoyuxtacortical, donde la sensibilidad de las secuencias T2 no es tan elevada. Sin embargo, en esta última situación es importante no confundir una lesión con realce con una estructura vascular leptomeníngea.
- Se define una lesión con realce como “nueva” cuando se localiza sobre una lesión visible en T2, y que no se realzaba en el estudio previo.
- En la mayoría de los casos, esta lesión también es nueva en T2, si bien ocasionalmente puede observarse un realce sobre una lesión preexistente en T2.
- Se define una lesión como con “realce persistente” cuando ya se identificaba en un estudio de RM efectuado previamente.
Normalmente, estas lesiones se asocian a una hiperseñal persistente en las secuencias T2, si bien su tamaño puede variar. Algunas placas desmielinizantes pueden ser parcial o completamente hiperintensas en secuencias T1 sin administración de contraste ( fig.6 ).
La presencia de estas lesiones es relativamente frecuente, especialmente en las formas secundarias progresivas, y se asocian a atrofia cerebral y discapacidad 30, No se conoce el mecanismo exacto por el cual algunas lesiones son hiperintensas en T1, ya que no se han realizado estudios de correlación radiopatológica.
En todo caso, este hecho hace recomendable realizar secuencias T1 sin contraste antes de administrar gadolinio, para evitar falsos positivos en la interpretación de lesiones activas en las secuencias T1 con contraste. Los artefactos de flujo pueden dificultar la interpretación de lesiones con realce especialmente en la fosa posterior.
Por ello, es necesario que las lesiones con realce situadas en la fosa posterior se asocien a un área de hiperseñal en T2, y que las secuencias T1 tras contraste se obtengan con gradientes de compensación de flujo (minimizan los artefactos de flujo). La valoración de las lesiones que realzan con contraste puede hacerse a partir del análisis visual de su número total (teniendo en cuenta que una lesión identificada en cortes consecutivos sólo cuenta como una) o bien cuantificando el número de áreas en las que se ve realce.
Esta última forma de cuantificación se aproxima más al análisis volumétrico de las lesiones con realce. Tipo de contraste, dosis y modo de administración Los contrastes utilizados en la práctica clínica son los que contienen gadolinio, que se administra vía intravenosa a una concentración de 0,5–1 mmol/ml, y con una dosis de 0,1-0,2 mmol/kg de peso.
La adquisición de la secuencia T1 tras la inyección intravenosa de contraste debe realizarse al menos 5-10 min tras su administración, y no más tarde de 20 min. Este tiempo puede utilizarse para obtener las secuencias fast -T2 o fast- FLAIR, sin que ello influya de forma significativa en su interpretación.
La utilización de dosis triple de contraste (0,3 mmol/kg) y/o la obtención de la secuencia T1 de forma retardada (20-30 min) son estrategias que si bien aumentan la sensibilidad en la detección de lesiones con realce, también disminuyen la especificidad 31–33,
El incremento de coste derivado del uso de estas estrategias, así como la falta de datos que demuestren una mayor eficacia (diagnóstica y pronóstica) de los estudios de RM, hace que no esté justificado su utilización en la práctica clínica habitual. La administración intravenosa de compuestos que contienen gadolinio está contraindicada o debe realizarse con precaución en pacientes con insuficiencia renal grave (estadios de enfermedad renal crónica 3, 4 y 5) o con fallo renal agudo, debido al riesgo de desarrollar una fibrosis sistémica nefrogénica 34,
Este riesgo se minimiza con la administración de las dosis mínimas necesarias (0,1 mmol/kg) y con la utilización de compuestos que han demostrado mayores perfiles de seguridad. También debe valorarse con precaución la administración de contraste a pacientes gestantes y en período de lactancia, ya que el gadolinio atraviesa la barrera placentaria y se excreta con la leche, por lo que es incorporado por el feto o ingerido por el lactante que, al tener un desarrollo renal incompleto, presentan un riesgo potencial de desarrollar una fibrosis sistémica nefrogénica.
- Lesiones activas en secuencias T2 Si bien las lesiones activas habitualmente se identifican a partir de la detección de lesiones que realzan con el contraste, también se pueden identificar mediante la detección de lesiones nuevas o que han aumentado de tamaño en las secuencias T2.
- La utilización combinada de estas dos secuencias (T1 con contraste y T2) incrementa hasta en un 10-15% la detección visual de lesiones activas en relación con la utilización aislada de las secuencias T1 con contraste 9,
La utilización de secuencias T2 en la detección de lesiones activas requiere el seguimiento estricto de unas recomendaciones que permiten alcanzar grados de precisión y reproducibilidad aceptables. En caso contrario, se ha descrito una reproducibilidad intraobservador de únicamente un 33% 35,
Las lesiones activas se identifican a partir del análisis visual conjunto de secuencias T2 de doble eco (corto y largo) obtenidas tanto con secuencias convencionales como con técnica rápida. Es prerrequisito esencial para la identificación de lesiones activas en T2 el correcto reposicionamiento entre las exploraciones a comparar.
Recomendaciones generales en la identificación de lesiones activas en T2 36 Es recomendable adoptar una actitud general conservadora en la identificación de lesiones activas en T2 para reducir el índice de falsos positivos.
• Pequeños focos de hiperseñal (< 3 mm) no deben considerarse relevantes. • Áreas en las que únicamente se identifica una tenue hiperseñal en relación con el parénquima normal no deben tenerse en cuenta. • La intensidad de señal de una lesión potencialmente activa debe ser mayor que la de la sustancia gris adyacente en la secuencia T2 obtenida con eco corto. • En caso de que una lesión potencialmente activa sea isointensa en relación con la sustancia gris adyacente en la secuencia T2 con eco corto, aún puede considerarse como lesión si su señal es claramente hiperintensa en el eco largo o si se identifica en dos cortes consecutivos. • El correcto reposicionamiento entre los estudios a comparar es un factor crítico a la hora de valorar lesiones activas en T2. En caso de reposicionamiento subóptimo se deben analizar con especial detalle los cortes adyacentes antes de asignar una lesión como activa, ya que desplazamientos rotacionales y paralelos pueden causar cambios aparentes en el tamaño y la posición de las lesiones. • En pacientes con volúmenes lesionales elevados, se hace especialmente difícil detectar lesiones activas en T2, sobre todo si el reposicionamiento no es óptimo. En esta situación se debe adoptar una actitud especialmente conservadora.
Definición de lesiones activas en T2 Lesiones “nuevas”: una lesión “nueva” se define como un área de hiperseñal en T2 que aparece en una zona de tejido que era normal en un estudio realizado previamente en secuencias T2 con eco corto. En general, es recomendable que esta hiperseñal se confirme en las secuencias T2 tanto con eco corto como con eco largo. Esta condición es obligada en las regiones anatómicas más susceptibles a artefactos de flujo, como los polos temporales y la fosa posterior. Una lesión también debe considerarse “nueva” si es contigua a una lesión preexistente pero conectada a ella por un área de baja señal relativa. En situaciones de reposicionamiento subóptimo una lesión “nueva” sólo puede considerarse en un área con lesión preexistente si se confirma en al menos dos cortes consecutivos. En la fosa posterior cualquier lesión “nueva” debe identificarse en las secuencias T2 obtenidas tanto con eco largo como con eco corto. Estas últimas son las más afectadas por artefactos de flujo, por lo que la detección de lesiones “nuevas” debe fundamentarse en las secuencias de eco largo. Lesiones “aumentadas”: en ocasiones es extremadamente difícil determinar si una lesión ha aumentado de tamaño o simplemente ha modificado su tamaño o forma por efecto de un reposicionamiento subóptimo. Por este motivo, nunca debe considerase una lesión como “aumentada” si sólo ha modificado su forma. Las lesiones de más de 5 mm de diámetro deben considerarse “aumentadas” sólo si han aumentado su diámetro en al menos un 100% o cuando se detecta un aumento de tamaño en al menos dos cortes consecutivos. En lesiones de < 5 mm ambos criterios deben cumplirse para clasificar una lesión como "aumentada". Dada la dificultad en hacer cumplir estos criterios en lesiones potencialmente "aumentadas" en la fosa posterior, se recomienda no contemplar esta posibilidad en lesiones de esta localización. Definición de las características topográficas y morfológicas de las lesiones desmielinizantes detectadas por RM La precisa identificación de las características de las lesiones focales detectadas en secuencias T2 es fundamental para determinar la posibilidad de su origen desmielinizante. Además, sus características topográficas contribuyen a determinar el riesgo de que un síndrome clínico aislado de probable origen desmielinizante se convierta en el futuro en EM, ya que se incluyen dentro de los criterios diagnósticos de McDonald 6, Se hace preciso, por lo tanto, disponer de unas definiciones lo más precisas posibles de las características morfológicas y topográficas de las lesiones desmielinizantes. Deben descartarse como lesiones los pequeños focos de hiperseñal con un diámetro inferior a 3 mm. especialmente si se sitúan en la sustancia blanca subcortical de los lóbulos frontales. También deben excluirse los focos de hiperseñal atribuibles a espacios perivasculares de Virchow-Robin (son isointensos con el LCR en las secuencias T2, tanto en el eco largo como en el corto). Las lesiones hiperintensas detectadas en las secuencias T2 se definen de la siguiente forma 37 :
• Lesiones subcorticales: lesiones localizadas en la sustancia blanca hemisférica cerebral que no contactan con las superficies ventriculares ni con el córtex. • Lesiones corticales-yuxtacorticales: lesiones situadas en la sustancia gris cortical y/o sustancia blanca yuxtacortical (fibras en U) ( fig.2 ). No se debe olvidar que la mielina también está en la sustancia gris, aunque en menor proporción que en la sustancia blanca y que, por lo tanto, las lesiones desmielinizantes con frecuencia afectan también a la sustancia gris cortical, tanto cerebral como cerebelosa. Sin embargo, las lesiones corticales puras son muy difíciles de identificar por RM, probablemente debido a su pequeño tamaño, el escaso contraste que muestran en relación con el LCR que las rodea y la menor reacción inflamatoria que presentan en comparación con las que afectan a la sustancia blanca. Las lesiones subcorticales se diferencian de las yuxtacorticales en que las últimas están en contacto con la sustancia gris cortical, mientras que en las primeras hay sustancia blanca interpuesta. Las lesiones periventriculares de gran tamaño que alcanzan periféricamente la sustancia blanca yuxtacortical no deben considerarse yuxtacorticales. La presencia de al menos una lesión corticoyuxtacortical se considera uno de los criterios diagnósticos propuestos por Barkhof et al 38, La secuencias fast- FLAIR y, sobre todo, las DIR (doble inversión-recuperación) son las más sensibles en la detección de estas lesiones. • Lesiones periventriculares: lesiones que contactan con los ventrículos laterales o más raramente con el tercer ventrículo. Las lesiones infratentoriales que contactan con la superficie del cuarto ventrículo no se consideran periventriculares. La presencia de al menos 3 lesiones periventriculares se considera uno de los criterios diagnósticos propuestos por Barkhof et al 38, • Lesiones de cuerpo calloso: lesiones focales que también pueden ser periventriculares. Las secuencias fast- FLAIR obtenidas en el plano sagital son especialmente sensibles en la detección de estas lesiones ( fig.1 ). En este plano, se requiere que las lesiones se sitúen en los dos tercios mediales del cuerpo calloso para evitar incluir las paracallosas. Las bandas transcallosas se identifican como líneas que atraviesan transversalmente el cuerpo calloso (se observan de forma óptima en secuencias T2 en el plano transversal), y corresponden a una degeneración walleriana del cuerpo calloso secundaria a lesiones paracallosas. Estas bandas no deben considerarse como lesiones de cuerpo calloso. • Lesiones talámicas o de ganglios basales: lesiones que se sitúan claramente en el seno de los núcleos grises. No se deben incluir las lesiones que afecten a los tractos de sustancia blanca y que contacten marginalmente con los núcleos. • Lesiones infratentoriales: lesiones que se sitúan en cerebelo, mesencéfalo, protuberancia o bulbo raquídeo. Debido a los frecuentes artefactos existentes en la fosa posterior se requiere que estas lesiones se identifiquen tanto en el eco corto como en el largo de las secuencias T2. Las secuencias fast- FLAIR son menos sensibles que las secuencias fast -T2 de doble eco en la identificación de lesiones infratentoriales ( fig.3 ). La presencia de al menos una lesión infratentorial se considera uno de los criterios diagnósticos propuestos por Barkhof et al 38, • Lesiones ovoideas: lesiones de morfología ovoidea con su eje mayor orientado de forma perpendicular a la pared ventricular 39, Corresponden a lesiones de localización perivenular (dedos de Dawson). Su presencia debe analizarse exclusivamente en imágenes obtenidas en el plano transversal ( fig.7 ). • Lesiónes grandes: lesiones con un diámetro > 6 mm, excluidas las lineales paralelas a las paredes ventriculares y las bandas transcallosas. • Agujeros negros: lesiones hipointensas en T1 (en secuencias obtenidas con spin echo ) en relación con la sustancia gris normal con una persistencia de al menos 6 meses y siempre asociadas con un área de hiperseñal en T2 ( fig.8 ). Si bien se consideraba que estas lesiones correspondían a lesiones desmielinizantes con un marcado componente de destrucción tisular (baja densidad axonal), recientes estudios de correlación histopatológica han demostrado una gran variabilidad en su sustrato patológico 40, Su presencia es más frecuente en pacientes con formas progresivas de EM, especialmente a nivel supratentorial, mientras que en general su detección es escasa a nivel infratentorial y medular 41, No se deben considerar agujeros negros las lesiones que tengan las características anteriores, pero que muestren realce total o parcial (generalmente periférico) tras la administración de contraste. Estos “seudoagujeros negros” son lesiones activas con un componente edematoso y desmielinizante, cuyos tamaño e hiposeñal en T1 pueden reducirse o desaparecer tras resolución de la actividad inflamatoria (cese del realce con el contraste) y desarrollo de remielinización. Por el contrario, los agujeros negros “crónicos” son irreversibles y su número o volumen se han relacionado con el grado de discapacidad, por lo que estos parámetros se han utilizado como un marcador de progresión del componente neurodegenerativo de la enfermedad. Algunos fármacos inmunomoduladores disminuyen la proporción de lesiones activas con gadolinio que se convierten en agujeros negros crónicos. • Lesiones seudotumorales: no se ha definido un diámetro mínimo a partir del cual una lesión desmielinizante focal se considera seudotumoral, si bien éste podría establecerse en 3 cm. No debe interpretarse como lesiones seudotumorales el área lesional resultante de la confluencia de múltiples lesiones. Las lesiones seudotumorales corresponden a lesiones activas generalmente en situación hemisférica cerebral que pueden causar síntomas clínicos indicativos de un proceso expansivo, si bien también pueden ser asintomáticas. En algunas ocasiones, puede ser difícil diferenciar las lesiones seudotumorales de lesiones tumorales o infecciosas. En estos casos, el contexto clínico, la presencia de un realce en anillo incompleto ( fig.9 ) o de un patrón lesional tipo Baló (anillos concéntricos) ( fig.10 ) y la detección de lesiones adicionales de características desmielinizantes en el resto del tejido cerebral o la médula espinal son los datos de más ayuda para establecer un correcto diagnóstico diferencial. En ocasiones, la obtención de secuencias de difusión y de un examen de espectroscopia localizada de protón sobre la lesión puede ser de ayuda diagnóstica para diferenciarlas de procesos tumorales o abscesos. • Sustancia blanca sucia (dirty white matter): áreas focales o difusas de discreta hiperseñal en secuencias T2, en relación con la sustancia blanca normal, situadas en la sustancia blanca próxima o no a lesiones focales subcorticales y que afectan, predominantemente y en ocasiones de forma simétrica, a la sustancia blanca profunda periventricular de los hemisferios cerebrales, especialmente en pacientes con formas progresivas de EM ( fig.11 ). Su señal es menos intensa que la de las lesiones focales y se aproxima a la de la sustancia gris cortical. Estas áreas, que deben tener al menos 10 mm de diámetro y que hay que identificarlas en al menos dos cortes transversales consecutivos, representan un componente difuso del proceso desmielinizante y de daño axonal 42 ; en ocasiones son difíciles de diferenciar de la sustancia blanca normal, por lo que su presencia aislada no debe considerase como un hallazgo anormal. • Lesiones medulares: las lesiones medulares son muy frecuentes en pacientes con EM y su detección incrementa la sensibilidad y la especificidad de los estudios de RM. Las lesiones en esta zona deben tener ciertas características para poder ser consideradas típicas de EM: ser hiperintensas en secuencias ponderadas en T2, tener más de 3 mm de diámetro, pero con una extensión craneocaudal inferior a dos cuerpos vertebrales, no producir tumefacción importante de la médula (con excepción de algunas lesiones sintomáticas en fase aguda) y afectar de forma incompleta al área transversal medular 14,
Secuencias de doble inversión-recuperación Las secuencias DIR se han introducido recientemente en el arsenal técnico de la RM. Estas secuencias utilizan un doble pulso de saturación que anula la señal del LCR y de la sustancia blanca 43, Como resultado la sustancia blanca aparece hipointensa, lo que permite un mayor contraste con las lesiones desmielinizantes (hiperintensas).
La secuencia DIR mejora el contraste de las lesiones corticoyuxtacorticales 44 e infratentoriales, e incrementa la sensibilidad en la detección de este tipo de lesiones en comparación con las secuencias clásicas ( fast -T2 de doble eco y fast- FLAIR). Su limitada disponibilidad en los equipos actuales y una baja relación señal-ruido, que obliga a tiempos de adquisición relativamente largos, son factores que han limitado su aplicación en los estudios clínicos.
RM de alto campo (3,0 T) Una forma de incrementar la sensibilidad de la RM en la detección de lesiones desmielinizantes en el SNC es mediante la utilización de equipos de alto campo (3,0 T). Estos equipos permiten detectar un 20-50% más de lesiones que realzan con gadolinio o hiperintensas en T2 en relación con equipos de RM de 1,5 T 45,46,
- Sin embargo, no hay datos que indiquen que esta mayor sensibilidad tenga impacto en la toma de decisiones terapéuticas en pacientes con una EM establecida.
- Sin embargo, en pacientes con un síndrome neurológico aislado, la mayor sensibilidad de los equipos de 3,0 T permite establecer con mayor frecuencia los criterios de diseminación espacial y temporal, lo que podría influir en un tratamiento precoz de un mayor número de pacientes 47,
Las secuencias fast- FLAIR se benefician especialmente de los campos de 3,0 T, al incrementar su sensibilidad en la detección de lesiones infratentoriales. Por otro lado, el efecto del alto campo en las secuencias T1 es negativo, especialmente cuando se utilizan secuencias en spin echo (alarga los tiempos de relajación longitudinal y, por lo tanto, disminuye el contraste tisular), por lo que es recomendable substituirlas por secuencias eco de gradiente 48,
Técnicas no convencionales de RM para diagnóstico y seguimiento de la EM En los últimos años se está realizando un gran esfuerzo en el desarrollo y la aplicación clínica de nuevas técnicas de RM que permitan detectar de forma específica, sencilla y reproducible lesiones macroscópicas o microscópicas cuyo sustrato patológico mejor se correlaciona con el grado de discapacidad clínica, como la desmielinización grave y la destrucción axonal.
Entre estas técnicas, cabe destacar la estimación del grado de daño axonal a partir de la cuantificación de la concentración de N-acetilaspartato obtenida mediante espectroscopia de protón, el cálculo del volumen cerebral y del área medular transversal, como medida de atrofia, la cuantificación del grado de mielinización a partir de la relación de transferencia de magnetización y la utilización de secuencias de difusión que caracterizan parcialmente el sustrato lesional de las lesiones macroscópicas y microscópicas y que miden la integridad y la organización de las fibras axonales.
Finalmente la RM funcional puede utilizarse en pacientes con EM para evaluar el efecto de la neuroplasticidad cerebral que explicaría, al menos parcialmente, la disociación clínico-radiológica en estos pacientes. Sin embargo, la rentabilidad de estas técnicas no convencionales en el diagnóstico y el seguimiento de la EM es limitada fuera de estudios experimentales o en ensayos clínicos, por lo que en general su uso no está justificado en los estudios de RM tanto diagnósticos como de seguimiento en la práctica clínica 5,49–51,
Espectroscopia de protón La espectroscopia de protón (ERM) es una técnica que permite obtener información bioquímica de las alteraciones patológicas en lesiones visibles en las secuencias T2 y en el tejido aparentemente normal. Hay cierta controversia en la literatura en relación con el valor diagnóstico de la ERM en el estudio de lesiones seudotumorales de origen desmielinizante para diferenciarlas de procesos tumorales.
Así, algunos autores apuntan a que no hay suficientes diferencias en el patrón espectral entre ambos procesos (disminución de n-acetil aspartato, elevación de la colina y de lípidos) 52,53, mientras que otros sí las encuentran, especialmente cuando se utilizan tiempos de eco diferentes y se realiza un análisis cuantitativo de diferentes metabolitos 54–56,
Por lo tanto, si bien la ERM puede utilizarse en casos seleccionados para la caracterización de lesiones seudotumorales, se debe ser cauto a la hora de tomar decisiones diagnósticas y terapéuticas únicamente fundamentadas en sus hallazgos. La ERM es capaz de detectar alteraciones bioquímicas en la sustancia blanca de apariencia normal en pacientes con EM, por lo que en estudios experimentales estos datos se han utilizado en la evaluación de la progresión de la enfermedad.
- La complejidad técnica de los estudios de ERM, su limitada reproducibilidad y el coste en tiempo han impedido el uso de la ERM como técnica de utilidad clínica en pacientes con EM.
- Además, los resultados obtenidos en ensayos clínicos con pequeños grupos de pacientes han sido contradictorios en cuanto al efecto de fármacos inmunomoduladores.
Por lo tanto, no hay datos suficientes que justifiquen el uso de la ERM en el diagnóstico y seguimiento de los pacientes con EM. Recientemente, se han publicado unas guías para la obtención de estudios multicéntricos de ERM 57, que intentan estandarizar los estudios realizados en diferentes centros.
- Volumen cerebral Está bien demostrado que los pacientes con EM desarrollan de forma progresiva atrofia cerebral.
- Los mecanismos por los que se produce esta atrofia progresiva no están completamente comprendidos, si bien parece claro que es consecuencia de una pérdidad axonal y mielínica, al menos de forma mayoritaria, se debe a una pérdida axonal y mielínica.
La relación entre las lesiones focales en el tejido cerebral y la atrofia no está bien determinada, ya que hay una disociación temporal entre el desarrollo progresivo de atrofia y el volumen de lesiones focales. Esta disociación apunta a que hay otros mecanismos en el desarrollo de atrofia, como puede ser una alteración difusa microscópica en la sustancia blanca y en la sustancia gris cortical y subcortical.
La cuantificación de la atrofia cerebral mediante RM se utiliza como medida del grado de pérdida de tejido cerebral en pacientes con EM 49,58,59, Estudios longitudinales han mostrado que el grado de atrofia progresa en algunos pacientes, y que esta progresión se correlaciona con un empeoramiento de la discapacidad.
La medida del volumen cerebral se puede calcular de una forma relativamente sencilla a partir de la obtención de imágenes ponderadas en T1 a las que se les aplica programas automáticos de segmentación que delimitan el contorno del parénquima encefálico y extraen el volumen ventricular; así se obtienen datos cuantitativos, precisos y reproducibles del volumen del parénquima encefálico.
La astrocitosis reactiva es un fenómeno que podría enmascarar la detección de atrofia cerebral en la EM, como consecuencia de aumentar el volumen cerebral. Además, el grado de atrofia puede verse sesgado por fluctuaciones en la concentración de agua atribuibles tanto a las lesiones activas como al efecto antiedema y antiinflamatorio de determinados tratamientos (corticoides, inmunomoduladores).
Estos factores que influyen en la medida del volumen cerebral hacen que, especialmente en las fases iniciales de la enfermedad, este parámetro probablemente subestime el grado real de daño axonal. La pérdida de volumen cerebral, que es aproximadamente 4 veces mayor en pacientes con EM que en la población normal, se produce principalmente a expensas de la sustancia gris, incluso en las fases iniciales de la enfermedad.
En comparación con el análisis volumétrico global cerebral o selectivo de la sustancia blanca, el análisis volumétrico selectivo de la sustancia gris se correlaciona mejor con el grado de discapacidad y la presencia de alteraciones neurocognitivas en pacientes con EM 60,61, Además, la detección de atrofia de la sustancia gris es la única forma cuantitativa de evaluar, mediante RM, el daño cortical en pacientes con EM, dada la insensibilidad de las técnicas convencionales en detectar la extensión lesional en ella.
Por lo tanto, parece que los estudios volumétricos cerebrales deben realizarse de forma selectiva en la sustancia gris, para lo cual se hacen necesarios programas de segmentación automáticos ( fig.12 ). Sin embargo, la precisión de estas medidas selectivas puede verse alterada por las lesiones desmielinizantes en la sustancia blanca que, con frecuencia, los programas de segmentación las clasifican de forma errónea como sustancia gris aparentemente normal 62, y que producen falsos incrementos en el volumen de la sustancia gris con la progresión de la enfermedad.
- Por lo tanto, estos programas deben aplicarse con enmascaramiento de las lesiones, lo que enlentece el procedimiento, haciéndolos difícilmente aplicables en la práctica clínica.
- Además, la cuantificación de la atrofia cerebral es relativamente insensible frente a cambios temporales (aproximadamente del 1-2% anual en los diferentes fenotipos de la enfermedad) 63,64, por lo que no parece una medida útil en la evaluación individual del efecto de tratamiento, al menos a corto o medio plazo.
Área medular La atrofia medular es un hallazgo relativamente frecuente en las formas progresivas de la enfermedad. Esta atrofia es más evidente en el segmento cervical y no guarda relación con el volumen lesional en T2, tanto cerebral como medular. El origen más probable de la atrofia medular es la destrucción axonal secundaria a degeneración walleriana.
Diferentes estudios han demostrado que el grado de atrofia de la médula cervical se correlaciona de forma significativa con el grado de discapacidad neurológica, mejorando sensiblemente la correlación obtenida con las medidas de volumen o número lesional tanto cerebral como medular en T2. La atrofia medular se puede cuantificar en el segmento cervical a partir de imágenes tridimensionales ponderadas en T1 obtenidas en el plano transversal con las que se realizan reconstrucciones transversales sobre el segmento C2-C3 en las que se calcula su área 65,
Transferencia de magnetización Está técnica de RM permite obtener datos cuantitativos, a partir de la relación de transferencia de magnetización (MTR), que miden de forma indirecta el grado de mielinización tanto de las placas desmielinizantes macroscópicas como de la sustancia blanca de apariencia normal 66–68,
Algunos estudios han demostrado que los valores de MTR varían con la evolución de las placas desmielinizantes, y esta variación se explica por la progresión en el grado de desmielinización (disminución de los valores de MTR) o por el desarrollo de remielinización (incremento de los valores de MTR) 69,70,
Esta capacidad de los valores de MTR de objetivar el grado de mielinización de una placa de forma longitudinal hace que esta técnica se utilice para analizar el potencial efecto neuroprotector de nuevos tratamientos. Sin embargo, su utilización en los estudios de RM diagnósticos y de seguimiento individual en pacientes con EM no está justificado, ya que no ha demostrado valor diagnóstico y pronóstico 50,51,
RM difusión La secuencia de difusión por RM puede utilizarse de forma complementaria a las secuencias convencionales en los estudios diagnósticos con el objeto de caracterizar lesiones desmielinizantes focales en cuyo diagnóstico diferencial se incluyan lesiones de naturaleza vascular aguda o infecciosa (abscesos).
Las imágenes del tensor de difusión permiten analizar la organización e integridad de las fibras axonales cerebrales y medulares en pacientes con EM mediante diferentes parámetros como la difusibilidad media y la fracción de anisotropía 71 y estudiar los cambios sutiles que se producen en la sustancia blanca y la sustancia gris de apariencia normal 72,
Estas variables han mostrado una buena correlación con el grado de discapacidad y de deterioro cognitivo. Sin embargo, no hay estudios que demuestren la utilidad de esta técnica de RM en el diagnóstico y el seguimiento de la EM 50,51, La RM difusión también permite obtener mapas axonales (tractografía) que ofrecen información sobre la organización de las conexiones corticales y de sus proyecciones en la sustancia blanca.
Esta técnica permite una visualización de los tractos de sustancia blanca tanto medulares como cerebrales y es capaz de objetivar alteraciones en su integridad no detectables con secuencias convencionales, y que podrían explicar determinadas manifestaciones clínicas 73 ( fig.13 ).
- Su utilidad actual se limita esencialmente a estudios de investigación.
- RM funcional La RM funcional (RMf) es una técnica de RM no invasiva que permite visualizar áreas cerebrales que se activan en relación con una tarea o un estímulo específicos.
- El uso clínico más habitual de la RMf es la identificación prequirúrgica de zonas funcionalmente críticas, con el objeto de facilitar la práctica de una cirugía lo más funcional posible.
La RMf también se está utilizando en el estudio de la anatomía funcional normal y para investigar el fenómeno de neuroplasticidad tanto en sujetos sanos como en pacientes con diferentes procesos neurológicos o psiquiátricos, entre los que destaca la EM.
- En pacientes con diferentes fenotipos de EM y grados de discapacidad, la RMf muestra cambios en el patrón de activación cortical ante paradigmas motores, sensitivos y cognitivos que probablemente reflejen una reorganización funcional cerebral como respuesta a la lesión tisular 74,
- Estos cambios incluyen un aumento en la intensidad de la activación cerebral normal y el reclutamiento de estructuras que normalmente no se activan.
Estos hallazgos, que se han interpretado como fenómenos adaptativos o compensatorios, intentan minimizar el grado de discapacidad motriz y cognitiva atribuible al daño neuroaxonal irreversible, y explicarían, al menos parcialmente, la disociación clínico-radiológica entre la extensión y la gravedad del daño neuroaxonal y de discapacidad en estos pacientes.
Estos patrones de hiperactividad cortical pueden variar en el tiempo en relación con un agotamiento de la capacidad de reorganización cortical y pueden modularse con terapias farmacológicas y rehabilitadoras 75, En un futuro, quizá pueda utilizarse la RMf como un marcador sustitutivo en la evaluación de la eficacia de terapias que modulen o promuevan el fenómeno de neuroplasticidad.
Conclusiones La RM es una técnica muy sensible y relativamente específica para identificar lesiones desmielinizantes en el SNC. El correcto análisis de los estudios ofrecen información diagnóstica y pronóstica, pero todavía es limitada la información obtenida del sustrato patológico lesional, incluso con técnicas de RM no convencionales, las cuales hoy prácticamente no tienen valor diagnóstico y pronóstico.
- La utilización de la RM en el diagnóstico y el seguimiento de los pacientes con EM en la práctica clínica debe realizarse bajo unas condiciones técnicas adecuadas y con unas indicaciones correctamente establecidas.
- Ello debe servir para racionalizar los recursos y optimizar la eficacia clínica derivada de los estudios de RM.
Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografía F. Fazekas, F. Barkhof, M. Filippi, et al, The contribution of magnetic resonance imaging to the diagnosis of multiple sclerosis. Neurology., 53 (1999), pp.448-457 P.A.
- Brex, O. Ciccarelli, J.I.
- O’Riordan, M.
- Sailer, A.J.
- Thompson, D.H. Miller.
- A longitudinal study of abnormalities on MRI and disability from multiple sclerosis.
- N Engl J Med., 346 (2002), pp.158-164 L.
- Appos, C.H.
- Polman, M.S.
- Freedman, et al,
- Treatment with interferon beta-1b delays conversion to clinically definite and McDonald MS in patients with clinically isolated syndromes.
Neurology., 67 (2006), pp.1242-1249 D.H. Miller, P. Runge, G. Johnson, et al, Serial gadolinium enhanced magnetic resonance imaging in multiple sclerosis. Brain., 111 (1988), pp.927-939 M. Filippi, V. Dousset, H.F. McFarland, D.H. Miller, R.I. Grossman. Role of magnetic resonance imaging in the diagnosis and monitoring of multiple sclerosis: consensous report of the white matter study group.
- J Magn Reson Imaging., 15 (2002), pp.499-504 W.I.
- McDonald, A.
- Compston, G.
- Edan, et al,
- Recommended diagnostic criteria for multiple sclerosis: guidelines from the international panel on the diagnosis of multiple sclerosis.
- Ann Neurol., 50 (2001), pp.121-127 M.
- Filippi, M.A.
- Horsfield, H.J.
- Ader, et al,
- Guidelines for using quantitative measures of brain magnetic resonance imaging abnormalities in monitoring the treatment of multiple sclerosis.
Ann Neurol., 43 (1998), pp.499-506 D.H. Miller, R.I. Grossman, S.C. Reingold, H.F. McFarland. The role of magnetic resonance techniques in understanding and managing multiple sclerosis. Brain., 121 (1998), pp.3-24 D.H. Miller, F. Barkhof, J.J. Nauta. Gadolinium enhancement increases the sensitivity of MRI in detecting disease activity in multiple sclerosis.
- Brain., 116 (1993), pp.1077-1094 M.A.
- Rocca, S.J.
- Hickman, L. Bö, F.
- Agosta, D.H.
- Miller, G.
- Comi, et al,
- Imaging the optic nerve in multiple sclerosis.
- Mult Scler., 11 (2005), pp.537-541 J.W.
- Thorpe, D.
- Idd, I.F.
- Moseley, et al,
- Spinal MRI in patients with suspected multiple sclerosis and negative brain MRI.
Brain., 119 (1996), pp.709-714 J.C. Bot, F. Barkhof, G. Lycklama a Nijeholt, et al, Differentiation of multiple sclerosis from other inflammatory disorders and cerebrovascular disease: value of spinal MR imaging. Radiology., 223 (2002), pp.46-56 A.J. Thompson, X.
Montalban, F. Barkhof, et al, Diagnostic criteria for primary progressive multiple sclerosis: a position paper. Ann Neurol., 47 (2000), pp.831-835 C.H. Polman, S.C. Reingold, G. Edan, M. Filippi, H.P. Hartung, L. Kappos, et al, Diagnostic criteria for multiple sclerosis: 2005 revisions to the “McDonald Criteria”.
Ann Neurol., 58 (2005), pp.840-846 W.B. Patola, B.A. Coulter, P.M. Chipperfield, S.S. Lingawi. A comparison of conventional spin-echo and fast spin-echo in the detection of multiple sclerosis. J Magn Reson Imaging., 13 (2001), pp.657-667 R.H. Hashemi, W.G. Bradley, D.Y.
- Chen, et al,
- Suspected multiple sclerosis: MR imaging with a thin-section fast FLAIR pulse sequence.
- Radiology., 196 (1995), pp.505-510 M.L.
- Gawne-Cain, J.I.
- O’Riordan, A.J.
- Thompson, I.F.
- Moseley, D.H. Miller.
- Multiple sclerosis lesion detection in the brain: a comparison of fast fluid-attenuated inversion recovery and conventional T2-weighted dual spin echo.
Neurology., 49 (1997), pp.364-370 T.A. Yousry, M. Filippi, C. Becker, M.A. Horsfield, R. Voltz. Comparison of MR pulse sequences in the detection of multiple sclerosis lesions. AJNR Am J Neuroradiol., 18 (1997), pp.959-963 G.J. Lycklama à Nijeholt, J.A. Castelijns, J.
- Weerets, et al,
- Sagittal MR of multiple sclerosis in the spinal cord: fast versus conventional spin-echo imaging.
- Am J Neuroradiol., 19 (1998), pp.355-360 G.
- Lycklama, A.
- Thompson, M.
- Filippi, et al,
- Spinal-cord MRI in multiple sclerosis.
- Lancet Neurol., 2 (2003), pp.555-562 D.
- Idd, J.W.
- Thorpe, A.J.
- Thompson, et al,
Spinal cord MRI using multi-array coils and fast spin echo. II. Findings in multiple sclerosis. Neurology., 43 (1993), pp.2632-2637 P.D. Molyneux, N. Tubridy, G.J. Parker, et al, The effect of section thickness on MR lesion detection and quantification in multiple sclerosis.
AJNR Am J Neuroradiol., 19 (1998), pp.1715-1720 M.L. Gawne-Cain, S. Webb, P. Tofts, D.H. Miller. Lesion volume measurement in multiple sclerosis: how important is accurate repositioning?. J Magn Reson Imaging., 6 (1996), pp.705-713 H.L. Gallagher, D.G. MacManus, S.L. Webb, D.H. Miller. A reproducible repositioning method for serial magnetic resonance imaging studies of the brain in treatment trials for multiple sclerosis.
J Magn Reson Imaging., 7 (1997), pp.439-441 M. Filippi, N. Marciano, R. Capra, et al, The effect of imprecise repositioning on lesion volume measurements in patients with multiple sclerosis. Neurology., 49 (1997), pp.274-276 I.L. Tan, R.A. Van Schijndel, F.
Fazekas, et al, Image registration and subtraction to detect active T(2) lesions in MS: an interobserver study. J Neurol., 249 (2002), pp.767-773 J.C. Masdeu, C. Quinto, C. Olivera, M. Tenner, D. Leslie, P. Visintainer. Open-ring imaging sign: highly specific for atypical brain demyelination. Neurology., 54 (2000), pp.1427-1433 F.
Cotton, H.L. Weiner, F.A. Jolesz, C.R. Guttmann. MRI contrast uptake in new lesions in relapsing-remitting MS followed at weekly intervals. Neurology., 60 (2003), pp.640-646 F. Barkhof, M. Filippi, J.H. Van Waesberghe, et al, Improving interobserver variation in reporting gadolinium-enhanced MRI lesions in multiple sclerosis.
- Neurology., 49 (1997), pp.1682-1688 V.
- Janardhan, S. Suri, R. Bakshi.
- Multiple sclerosis: hyperintense lesions in the brain on nonenhanced T1-weighted MR images evidenced as areas of T1 shortening.
- Radiology., 244 (2007), pp.823-831 M.
- Filippi, T.
- Yousry, A.
- Campi, et al,
- Comparison of triple dose versus standard dose gadolinium-DTPA for detection of MRI enhancing lesions in patients with MS.
Neurology., 46 (1996), pp.379-384 V.P. Mathews, K.S. Caldemeyer, J.L. Ulmer, H. Nguyen, W.T. Yuh. Effects of contrast dose, delayed imaging, and magnetization transfer saturation on gadolinium-enhanced MR imaging of brain lesions. J Magn Reson Imaging., 7 (1997), pp.14-22 F.
Sardanelli, A. Iozzelli, C. Losacco, A. Murialdo, M. Filippi. Three subsequent single doses of gadolinium chelate for brain MR imaging in multiple sclerosis. AJNR Am J Neuroradiol., 24 (2003), pp.658-662 D.R. Broome. Nephrogenic systemic fibrosis associated with gadolinium based contrast agents: a summary of the medical literature reporting.
Eur J Radiol., 66 (2008), pp.230-234 M.A. Van Walderveen, F. Barkhof, O.R. Hommes, et al, Correlating MRI and clinical disease activity in multiple sclerosis: relevance of hypointense lesions on short-TR/short-TE (T1-weighted) spin-echo images. Neurology., 45 (1995), pp.1684-1690 P.D.
Molyneux, D.H. Miller, M. Filippi, et al, Visual analysis of serial T2-weighted MRI in multiple sclerosis: intra- and interobserver reproducibility. Neuroradiology., 41 (1999), pp.882-888 CHAMPS Study Group. MRI predictors of early conversion to clinically definite MS in the CHAMPS placebo group. Neurology., 59 (2002), pp.998-1005 F.
Barkhof, M. Filippi, D.H. Miller, et al, Comparison of MRI criteria at first presentation to predict conversion to clinically definite multiple sclerosis. Brain., 120 (1997), pp.2059-2069 A.L. Horowitz, R.D. Kaplan, G. Grewe, R.T. White, L.M. Salberg. The ovoid lesion: a new MR observation in patients with multiple sclerosis.
AJNR Am J Neuroradiol., 10 (1989), pp.303-305 A. Bitsch, T. Kuhlmann, C. Stadelmann, H. Lassmann, C. Lucchinetti, W. Bruck. A longitudinal MRI study of histopathologically defined hypointense multiple sclerosis lesions. Ann Neurol., 49 (2001), pp.793-796 A. Gass, M. Filippi, M.E. Rodegher, A. Schwartz, G. Comi, M.G.
Hennerici. Characteristics of chronic MS lesions in the cerebrum, brainstem, spinal cord, and optic nerve on T1-weighted MRI. Neurology., 50 (1998), pp.548-550 A. Seewann, H. Vrenken, P. Van der Valk, et al, Diffusely abnormal white matter in chronic multiple sclerosis: imaging and histopathologic analysis.
- Arch Neurol., 66 (2009), pp.601-609 B.J.
- Bedell, P.A. Narayana.
- Implementation and evaluation of a new pulse sequence for rapid acquisition of double inversion recovery images for simultaneous suppression of white matter and CSF.
- J Magn Reson Imaging., 8 (1998), pp.544-547 J.J.
- Geurts, P.J.
- Pouwels, B.M.
- Uitdehaag, C.H.
Polman, F. Barkhof, J.A. Castelijns. Intracortical lesions in multiple sclerosis: improved detection with 3D double inversion-recovery MR imaging. Radiology., 236 (2005), pp.254-260 M.K. Erskine, L.L. Cook, K.E. Riddle, J.R. Mitchell, S.J. Karlik. Resolution-dependent estimates of multiple sclerosis lesion loads.
- Can J Neurol Sci., 32 (2005), pp.205-212 N.L.
- Sicotte, R.R.
- Voskuhl, S.
- Bouvier, R.
- Lutch, M.S.
- Cohen, J.C.
- Mazziotta.
- Comparison of multiple sclerosis lesions at 1.5 and 3.0 Tesla.
- Invest Radiol., 38 (2003), pp.423-427 M.P.
- Wattjes, M.
- Harzheim, C.K.
- Uhl, et al,
- Does high-field MR imaging have an influence on the classification of patients with clinically isolated syndromes according to current diagnostic MR imaging criteria for multiple sclerosis?.
AJNR Am J Neuroradiol., 27 (2006), pp.1794-1798 B.L. Schmitz, A.J. Aschoff, M.H. Hoffmann, G. Grön. Advantages and pitfalls in 3T MR brain imaging: a pictorial review. AJNR Am J Neuroradiol., 26 (2005), pp.2229-2237 D.H. Miller. Biomarkers and surrogate outcomes in neurodegenerative disease: lessons from multiple sclerosis.
- NeuroRx., 1 (2004), pp.284-294 R.
- Bakshi, A.
- Minagar, Z.
- Jaisani, J.S. Wolinsky.
- Imaging of multiple sclerosis: role in neurotherapeutics.
- NeuroRx., 2 (2005), pp.277-303 R.
- Zivadinov, M.
- Stosic, J.L. Cox, D.P.
- Ramasamy, M.G. Dwyer.
- The place of conventional MRI and newly emerging MRI techniques in monitoring different aspects of treatment outcome.
J Neurol., 255 (2008), pp.61-74 M. Law, D.E. Meltzer, S. Cha. Spectroscopic magnetic resonance imaging of a tumefactive demyelinating lesion. Neuroradiology., 44 (2002), pp.986-989 T. Ernst, L. Chang, I. Walot, K. Huff. Physiologic MRI of a tumefactive multiple sclerosis lesion.
Neurology., 51 (1998), pp.1486-1488 N. De Stefano, Z. Caramanos, M.C. Preul, G. Francis, J.P. Antel, D.L. Arnold. In vivo differentiation of astrocytic brain tumors and isolated demyelinating lesions of the type seen in multiple sclerosis using 1H magnetic resonance spectroscopic imaging. Ann Neurol., 44 (1998), pp.273-278 N.
De Stefano, M.L. Bartolozzi, L. Guidi, M.L. Stromillo, A. Federico. Magnetic resonance spectroscopy as a measure of brain damage in multiple sclerosis. J Neurol Sci., 233 (2005), pp.203-208 C. Majós, C. Aguilera, J. Alonso, et al, Proton MR spectroscopy improves discrimination between tumor and pseudotumoral lesion in solid brain masses.
AJNR Am J Neuroradiol., 30 (2009), pp.544-551 N. De Stefano, M. Filippi, D. Miller, et al, Guidelines for using proton MR spectroscopy in multicenter clinical MS studies. Neurology., 69 (2007), pp.1942-1952 J.H. Simon. Brain atrophy in multiple sclerosis: what we know and would like to know. Mult Scler., 12 (2006), pp.679-687 R.A.
Bermel, R. Bakshi. The measurement and clinical relevance of brain atrophy in multiple sclerosis. Lancet Neurol., 5 (2006), pp.158-170 E. Fisher, J.C. Lee, K. Nakamura, R.A. Rudick. Gray matter atrophy in multiple sclerosis: a longitudinal study. Ann Neurol., 64 (2008), pp.255-265 R.A.
Rudick, J.C. Lee, K. Nakamura, E. Fisher. Gray matter atrophy correlates with MS disability progression measured with MSFC but not EDSS. J Neurol Sci., 282 (2009), D.T. Chard, C.M. Griffin, G.J. Parker, et al, Brain atrophy in clinically early relapsing-remitting multiple sclerosis. Brain., 125 (2002), pp.327-337 R.A.
Rudick, E. Fisher, J.C. Lee, J. Simon, L. Jacobs, Multiple Sclerosis Collaborative Research Group. Use of the brain parenchymal fraction to measure whole brain atrophy in relapsing-remitting MS. Neurology., 53 (1999), pp.1698-1704 D.H. Miller, F. Barkhof, J.A.
- Frank, G.J.
- Parker, A.J. Thompson.
- Measurement of atrophy in multiple sclerosis: pathological basis, methodological aspects and clinical relevance.
- Brain., 125 (2002), pp.1676-1695 N.A.
- Losseff, S.L.
- Webb, J.I.
- O’Riordan, et al,
- Spinal cord atrophy and disability in multiple sclerosis.
- A new reproducible and sensitive MRI method with potential to monitor disease progression.
Brain., 119 (1996), pp.701-708 A. Rovira, J. Alonso, G. Cucurella, et al, Evolution of multiple sclerosis lesions on serial contrast-enhanced T1-weighted and magnetization-transfer MR images. AJNR Am J Neuroradiol., 20 (1999), pp.1939-1945 M.A. Horsfield.
Magnetization transfer imaging in multiple sclerosis. J Neuroimaging., 15 (2005), pp.58S-67S C. Oreja-Guevara, A. Charyl, D. Caputo, R. Cavarretta, M.P. Sormani, M. Filippi. Magnetization transfer magnetic resonance imaging and clinical changes in patients with relapsing-remitting multiple sclerosis. Arch Neurol., 63 (2006), pp.736-740 J.T.
Chen, D.L. Collins, H.L. Atkins, et al, Magnetization transfer ratio evolution with demyelination and remyelination in multiple sclerosis lesions. Ann Neurol., 63 (2008), pp.254-262 P.S. Giacomini, I.R. Levesque, L. Ribeiro, et al, Measuring demyelination and remyelination in acute multiple sclerosis lesion voxels.
Arch Neurol., 66 (2009), pp.375-381 M. Rovaris, A. Gass, R. Bammer, et al, Diffusion MRI in multiple sclerosis. Neurology., 65 (2005), pp.1526-1532 C. Oreja-Guevara, M. Rovaris, G. Iannucci, P. Valvasina, D. Caputo, R. Cavarretta, et al, Progressive grey matter damage in patients with relapsing-remitting MS: A longitudinal difussion tensor MRI study.
Arch Neurol., 62 (2005), pp.578-584 J. Renoux, D. Facon, P. Fillard, et al, MR diffusion tensor imaging and fiber tracking in inflammatory diseases of the spinal cord. AJNR Am J Neuroradiol., 27 (2006), pp.1947-1951 P. Pantano, C. Mainero, F. Caramia. Functional brain reorganization in multiple sclerosis: evidence from fMRI studies.
¿Que separa el cerebro del cerebelo?
La hoz del cerebelo: separa en este órgano a dos mitades o hemisferios cerebelosos. La tienda del cerebelo : separa el cerebelo del cerebro.
¿Qué es la región supratentorial?
La región supratentorial ( la porción superior del encéfalo ) contiene el cerebro, un ventrículo lateral y el tercer ventrículo (con el líquido cefalorraquídeo que se muestra en azul), el plexo coroideo, la glándula pineal, el hipotálamo, la hipófisis y un nervio óptico.
¿Qué es lesion Supratentorial?
Las lesiones supratentoriales o hemisféricas de diverso origen (infarto maligno de arteria cerebral media, hemorragia intraparenquimatosa, hematoma subdural, tumores, etc) tienen en común la presencia de un efecto de masa que producirá una distorisón del parénquima llevando a herniaciones de la línea media: herniación
¿Dónde está el tentorio?
(3.02) El encéfalo está contenido dentro de la cavidad craneana. Aquí está la cavidad craneana en un cráneo seco, tiene casi la misma forma del encéfalo. Como vimos en el último video, dos grandes accidentes óseos dividen el piso de la cavidad craneana en tres partes.
- El borde del esfenoides separa la fosa craneana anterior de la fosa craneana media.
- Esta parte del cerebro, el lóbulo frontal, ocupa la fosa craneana anterior.
- Esta parte, el lóbulo temporal, ocupa la fosa craneana media.
- La porción petrosa del hueso temporal separa la fosa craneana media de la fosa craneana posterior, la cual contiene el cerebelo y el tronco cerebral.
Aquí vemos el foramen o agujero magno. Ahora apreciemos como se ve la cavidad craneana en el cuerpo vivo. La cavidad craneana está tapizada por esta gruesa y brillante capa de tejido fibroso: la duramadre. Abajo, la capa de duramadre pasa a través del foramen magno, continuándose con la duramadre que tapiza el canal vertebral.
- Dos extensiones importantes de la duramadre separan las regiones del encéfalo en la cavidad craneana.
- Estas son la hoz del cerebro y el tentorio o tienda del cerebelo.
- Aquí está el tentorio.
- Su nombre completo es tienda del cerebelo y separa la fosa craneana posterior del resto de la cavidad craneana, y separa dos partes principales del encéfalo, el cerebro (arriba) del cerebelo (abajo).
Esta abertura del tentorio se denomina incisura tentorial, por ahí pasa el tronco cerebral desde la fosa craneal posterior hacia la media. El tentorio o tienda del cerebelo se inserta en la cara interna del hueso occipital, a lo largo de la porción petrosa del hueso temporal y termina en las apófisis clinoides posteriores del esfenoides.
La parte superior del tentorio se continúa con la duramadre del piso de la fosa craneal media. En, (3.02) El encéfalo está contenido dentro de la cavidad craneana. Aquí está la cavidad craneana en un cráneo seco, tiene casi la misma forma del encéfalo. Como vimos en el último video, dos grandes accidentes óseos dividen el piso de la cavidad craneana en tres partes.
El borde del esfenoides separa la fosa craneana anterior de la fosa craneana media. Esta parte del cerebro, el lóbulo frontal, ocupa la fosa craneana anterior. Esta parte, el lóbulo temporal, ocupa la fosa craneana media. La porción petrosa del hueso temporal separa la fosa craneana media de la fosa craneana posterior, la cual contiene el cerebelo y el tronco cerebral.
- Aquí vemos el foramen o agujero magno.
- Ahora apreciemos como se ve la cavidad craneana en el cuerpo vivo.
- La cavidad craneana está tapizada por esta gruesa y brillante capa de tejido fibroso: la duramadre.
- Abajo, la capa de duramadre pasa a través del foramen magno, continuándose con la duramadre que tapiza el canal vertebral.
Dos extensiones importantes de la duramadre separan las regiones del encéfalo en la cavidad craneana. Estas son la hoz del cerebro y el tentorio o tienda del cerebelo. Aquí está el tentorio. Su nombre completo es tienda del cerebelo y separa la fosa craneana posterior del resto de la cavidad craneana, y separa dos partes principales del encéfalo, el cerebro (arriba) del cerebelo (abajo).
Esta abertura del tentorio se denomina incisura tentorial, por ahí pasa el tronco cerebral desde la fosa craneal posterior hacia la media. El tentorio o tienda del cerebelo se inserta en la cara interna del hueso occipital, a lo largo de la porción petrosa del hueso temporal y termina en las apófisis clinoides posteriores del esfenoides.
La parte superior del tentorio se continúa con la duramadre del piso de la fosa craneal media. En la línea media, el tentorio se inserta en la hoz del cerebro, la cual pondremos en la imagen. Esta es la hoz del cerebro. La hoz forma la división en la línea media entre los dos hemisferios cerebrales.
¿Que se detecta en una resonancia magnética de cerebro?
Una resonancia magnética proporciona imágenes detalladas de los tejidos del cerebro y los nervios. Una resonancia magnética del cerebro puede usarse para diagnosticar y vigilar muchas enfermedades y trastornos que afectan dicho órgano, como: Anomalía congénita.
¿Qué provoca las lesiones cerebrales?
Tipos de lesiones cerebrales adquiridas – Hay dos tipos de lesión cerebral adquirida. Lesión cerebral traumática Una lesión cerebral traumática se produce cuando una fuerza externa, como un golpe, un puñetazo o sacudida en la cabeza, o una lesión penetrante, interrumpe el funcionamiento normal del cerebro. Las causas más frecuentes son:
Las caídas desde alturas, los resbalones, las caídas por escaleras y la pérdida del equilibrio.Golpes recibidos por derrumbes de la construcción, por el impacto contra un vehículo o por acciones violentas.Accidentes de automóvil, motocicletas o vehículos todo terreno.Actos de violencia, como la violencia doméstica o de pandillas, un asalto, o el síndrome provocado al sacudir violentamente a un bebé.Las lesiones provocadas por explosiones o detonaciones, especialmente las ocurridas a los miembros de las Fuerzas Armadas.
Lesión cerebral no traumática Este tipo de lesiones son ocasionadas por un problema cerebral interno, y no por una fuerza externa. Algunas de las causas más comunes son:
El accidente cerebrovascular.Infecciones como la meningitis o la encefalitis.La falta o escasez de oxígeno en el cerebro provocada por un inicio de ahogamiento, o por asfixia, estrangulación o aspiración.Los tumores cerebrales.Exposición a las toxinas de los productos de limpieza, pesticidas, o del plomo o el mercurio.Las drogas, como la cocaína, las metanfetaminas, los inhalantes o la MDMA (éxtasis).
Todas las lesiones cerebrales son graves y pueden alterar la vida de quienes las sufren. El proceso de recuperación a menudo suele ser el mismo para los distintos tipos de lesiones cerebrales. La diferencia entre unas y otras está en cómo ocurre la lesión cerebral.
¿Qué parte del cerebelo se encarga del equilibrio?
Configuración interna del cerebelo – Se divide en sustancia gris y sustancia blanca:
Sustancia gris. Se compone de 4 núcleos cerebelosos y de la corteza. Estos 4 núcleos son:
Núcleo fastigial. Tiene que ver con las funciones del equilibrio. Núcleo globoso. Tiene la forma de la letra “S”. Núcleo emboliforme. Se encarga de los movimientos de las extremidades. Núcleo dentado. Es el más desarrollado y es el que se conecta con el neo-cerebelo.
Sustancia blanca. Se encuentra en la parte media del cerebelo. Se presenta en forma ramificada. Por esta razón recibe el nombre de árbol de la vida,
¿Cuál es la parte del cerebro que controla el equilibrio?
El cerebelo es la parte posterior del cerebro, bajo el encéfalo. Controla la coordinación y el balance.
¿Cuál es la parte del cerebro que se encarga de la memoria?
El hipocampo y la corteza temporal se han reconocido como las estructuras más importantes en los procesos amnésicos. El hipocampo se ha relacionado con la memoria reciente (minutos, horas o pocos días) y la corteza temporal, con el almacenamiento de información remota (días, meses o años).
¿Qué parte del cerebro controla la memoria y el aprendizaje?
Hipocampo : área ubicada al interior del lóbulo temporal, es importante para la memoria y el aprendizaje.
¿Cómo se llama la parte más superficial del cerebro?
Autor: Santiago Nova MD • Revisor: Blanca Navarro LCP Última revisión: 13 de Julio de 2023 Tiempo de lectura: 23 minutos La corteza cerebral (córtex cerebral o corteza del encéfalo) es la capa externa de sustancia gris que cubre por completo la superficie de ambos hemisferios cerebrales,
Tiene un grosor aproximado de 2-4 mm y consta de los cuerpos neuronales o somas. Esta capa se pliega de forma compleja, con elevaciones conocidas como giros o circunvoluciones y depresiones llamadas surcos o cisuras. La corteza cerebral es un término distinto al de cerebro (prosencéfalo), el cual incluye los dos hemisferios cerebrales (derecho e izquierdo) y es la porción más grande del encéfalo.
El cerebro consta de la sustancia gris externa (la corteza cerebral) y la masa interna de sustancia blanca (axones mielinizados), la cual forma la mayor parte de las estructuras profundas de los hemisferios cerebrales y las estructuras de la subcorteza cerebral tales como el diencéfalo, la glándula hipófisis (pituitaria), las estructuras del sistema límbico y los núcleos o ganglios basales,
- La corteza cerebral se organiza en diferentes áreas funcionales como las áreas sensitivas, motoras y de asociación,
- Tiene una gran variedad de funciones, entre ellas la percepción e interpretación de la información sensitiva y la planeación e iniciación de la actividad motora.
- También cumple un papel importante en las funciones cognitivas superiores como la toma de decisiones, la motivación, la atención, el aprendizaje, la memoria, la capacidad de resolver problemas y el pensamiento conceptual.
En este artículo aprenderemos la anatomía, funciones y tipos de la corteza cerebral.
Puntos clave sobre la corteza cerebral| Definición | Capa de materia gris externa de los hemisferios cerebrales |
| Lóbulos | Cada hemisferio se divide en seis lóbulos : frontal, parietal, temporal, occipital, ínsula y límbico |
| Surcos principales | Surco lateral (cisura de Silvio): separa el lóbulo temporal de los lóbulos frontal y parietal Surco central (cisura de Rolando): separa el lóbulo frontal del parietal Surco parietooccipital: separa el lóbulo parietal del occipital Surco cingular: separa el lóbulo límbico de los lóbulos frontal y parietal Surco colateral: se encuentra entre el lóbulo límbico y temporal |
| Giros principales | Lóbulo frontal: giro precentral, frontal superior, frontal medio y frontal inferior Lóbulo parietal: giro postcentral, lóbulo parietal superior, lóbulo parietal inferior (giros supramarginal y angular) Lóbulo temporal: giros temporal superior, temporal medio y temporal inferior Lóbulo occipital: giros occipital superior, occipital medio y occipital inferior; cuña, giro lingual Lóbulo de la ínsula: giros cortos y giros largos de la ínsula Lóbulo límbico: giros paraterminal, cingular, parahipocampal |
| Áreas corticales principales/Unidades funcionales | Lóbulo frontal: corteza prefrontal, corteza premotora, corteza motora primaria (área 6 de Brodmann), área de Broca (áreas 44 y 45 de Brodmann) Lóbulo parietal: corteza somatosensitiva primaria Lóbulo temporal: corteza auditiva primaria, área de Wernicke Lóbulo occipital: corteza visual primaria (área 17 de Brodmann) |
| Irrigación | Ramas corticales de las arterias cerebrales anterior, media y posterior |
| Funciones | Control del movimiento voluntario, atención, aprendizaje, memoria, motivación, toma de decisiones, planeación, solución de problemas, pensamiento conceptual, percepción de estímulos sensitivos, procesamiento del lenguaje, procesamiento visual e interpretación, modulación de emociones |
¿Qué pasa si se daña la sustancia blanca del cerebro?
¿Qué son las leucodistrofias? – Las leucodistrofias son un grupo de trastornos genéticos raros que afectan el sistema nervioso central, el que está formado por su cerebro y médula espinal. Las leucodistrofias dañan la sustancia blanca (o materia blanca) de su sistema nervioso central. La sustancia blanca incluye:
Fibras nerviosas: Conectan las células nerviosas, también se conocen como axones Mielina: Capa de proteínas y materia grasa que recubre y protege las fibras nerviosas. También ayuda a acelerar las señales entre las células nerviosas
Cuando la sustancia blanca está dañada, puede hacer más lentas o bloquear las señales entre las células nerviosas. Esto puede causar muchos síntomas diferentes, incluyendo problemas de movimiento, vista, audición y pensamiento. Hay más de 50 tipos de leucodistrofias.
¿Qué es una lesión cerebral leve?
Una lesión cerebral traumática leve o conmoción cerebral es causada por un golpe o una sacudida en la cabeza o el cuerpo que hace que: La cabeza y el cerebro se muevan rápidamente de un lado a otro. El cerebro rebote y gire dentro del cráneo a causa de este movimiento brusco.
¿Qué consecuencias podria tener una lesión en el cerebro?
Signos y síntomas – Las lesiones cerebrales suelen dar lugar a deficiencias o discapacidades que pueden variar mucho en intensidad. En caso de lesiones cerebrales graves, la probabilidad de sufrir una discapacidad en ciertas áreas es mayor, esto incluye deficiencias neurocognitivas, delirios (para ser específicos, delirios monotemáticos), trastornos del habla y del movimiento, y retrasos mentales,
También pueden darse trastornos de personalidad. Los casos más graves terminan en coma (medicina) o incluso en estado vegetativo persistente. Inclusive un incidente leve puede tener asociadas consecuencias de larga duración o puede causar síntomas que se manifiesten años más tarde. La lesión cerebral, ya sea causada por un ictus, por consumo excesivo de alcohol, por un traumatismo craneoencefálico o por una insuficiencia de vitamina B, en ocasiones puede dar lugar al Psicosis de Korsakoff, según el cual el paciente se ve sumido en fabulaciones.
Las fabulaciones causan incapacidad para separar los recuerdos de sueños diurnos de los recuerdos reales, llenando estas lagunas en la memoria con fantasías. Al igual que en el resto de lesiones cerebrales, la psicosis de Korsakoff es frecuentemente diagnosticada erróneamente como una esquizofrenia, en este caso.
¿Qué significa tener un nivel de conciencia bajo?
En general, se usa el término para aquellos pacientes con una reducción leve o moderada del estado de alerta, acompañada por un interés disminuido del ambiente, con respuestas más lentas a la estimulación y un incremento en el número de horas de sueño.
¿Cómo se llama el cerebelo?
Cerebelo o zona del encéfalo.
¿Cómo se divide el cerebelo?
La corteza cerebelosa presenta tres zonas funcionales definidas por sus conexiones y que sirven para clasificar los circuitos cerebelosos. Estas son la zona medial (vermiana), intermedia (paravermiana) y lateral (hemisférica). control del equilibrio.
¿Qué arteria irriga el cerebelo?
Las Arterias Vertebrales entran en la cavidad craneana uniéndose y formando un tronco común que conocemos como Arteria Basilar, que irrigará el cerebelo y el tronco cerebral.
¿Qué es el tentorio del cerebro?
Anatomía – La tienda del cerebelo es una lámina arqueada, elevada en el medio, y que se inclina hacia abajo hacia la circunferencia. Cubre la superficie superior del cerebelo y soporta el lóbulo occipital del cerebro. Su borde anterior es libre y cóncavo, y limita una gran apertura oval, la incisura tentorii, para la transmisión del pedúnculo cerebral.
Está unida posteriormente, por su borde convexo, a las crestas transversas sobre la superficie interna del hueso occipital, encerrando los senos transversos ; delante, el ángulo superior de la parte petrosa del temporal de cada lado encerrando los senos petrosos superiores. En el vértice de la parte petrosa del hueso temporal, se cruzan entre sí fijándose en la apófisis clinoides anterior y posterior respectivamente.
En el borde posterior de la línea media de la cara superior, se fija la hoz del cerebro, el seno recto se localiza en su punto de unión.
¿Cómo se denomina comúnmente la parte superior del tallo cerebral?
Partes del tronco encefálico – En el reino vegetal, la mayor parte de las flores están unidas a la planta mediante un tallo. De la misma manera la mayor parte del tejido del encéfalo está conectado al resto del sistema nervioso central mediante el tronco encefálico, que es una especie de proyección en forma de tallo que se extiende caudalmente desde la base del cerebro, y hace posible la comunicación entre el cerebro, el cerebelo y la médula espinal.
El tronco encefálico comienza a nivel de los pedúnculos cerebrales adelante y a nivel de la lámina tectal o cuadrigémina por detrás. Continúa caudalmente siguiendo una dirección ligeramente posteroinferior hasta que termina a nivel de la decusación de las pirámides (a nivel del foramen magno del cráneo).
El tronco encefálico es más ancho arriba y más estrecho abajo. Podemos distinguir en él tres partes principales:
El bulbo raquídeo (médula oblongada) es la porción más estrecha y caudal El puente (protuberancia anular) corresponde al segmento medio del tronco encefálico El mesencéfalo es el segmento más ancho y más craneal del tronco encefálico
La división que hemos mencionado anteriormente está realizada en sentido horizontal y es la más conocida, sin embargo el tronco encefálico también puede dividirse en sentido vertical. La mayor parte de los textos enfatizan mucho esta división en referencia al mesencéfalo, sin embargo esta se extiende también a las otras porciones del tronco encefálico.
Los términos techo (tectum en latín) y tegmento (proveniente de tegmentum, término que en latín significa cubierta) se usan para identificar esta división en relación a la cavidad central del sistema nervioso central. Techo, tegmento y área basal del tronco encefálico (diagrama) El techo es la pared posterior y superior de la cavidad mientras que el tegmento es su cobertura anteroinferior o piso.
El conducto central de la médula espinal tiene a nivel del tronco encefálico diferentes dilataciones como el acueducto mesencefálico o el cuarto ventrículo, por lo tanto a este nivel el techo es la pared posterosuperior del acueducto del mesencéfalo y del cuarto ventrículo del puente; mientras que el tegmento se ubica anterior e inferior a estas cavidades.
Sin embargo, el pie del pedúnculo cerebral y la parte basilar del puente (descrita a continuación) no son considerados parte del tegmento, Esto se debe a que ambas estructuras no forman parte del tubo neural primitivo, sino que se desarrollan de forma más tardía en el embrión. Como resultado de esto, se consideran y tratan como entidades anatómicas diferentes al techo y al tegmento.
¡Echa un vistazo a nuestros cuestionarios de anatomía y aprende más rápido! Cada porción del tronco encefálico tiene sus características anatómicas únicas y alberga núcleos y vías especiales que son parte importante de nuestras actividades diarias. Algunos de estos núcleos y tractos ocupan más de una parte del tronco encefálico y por lo tanto podrían ser mencionadas más de una vez en este artículo.
Existen además numerosas estructuras importantes alrededor del tronco encefálico que tienden a aparecer bastante en cuestionarios y exámenes, de las cuales también hablaremos hoy. Es más sencillo hablar del tronco encefálico siguiendo un orden caudocraneal, ya que la parte inferior posee menos estructuras en comparación con el extremo superior.
Por lo tanto, nuestra revisión comenzará con el bulbo raquídeo.
¿Qué es hiperintensidad de la sustancia blanca subcortical?
Las hiperintensidades de la sustancia blanca son lesiones en este tejido cerebral que se han asociado a factores de riesgo cardiovasculares. Estas lesiones se detectan con frecuencia en el cerebro de personas de edad avanzada y se han relacionado con un riesgo aumentado de enfermedad de Alzheimer.
¿Cuáles son los pedúnculos cerebrales?
Vías ascendentes – El mesencéfalo facilita el paso de muchas vías ascendentes. Siendo más específicos, estas se conocen como los pedúnculos cerebelosos superiores, el fascículo longitudinal medial, el lemnisco medial, el lemnisco lateral, el lemnisco trigeminal y el lemnisco espinal.
- Los pedúnculos cerebelosos superiores son los fascículos de sustancia blanca pareadas que conectan al cerebelo con el mesencéfalo.
- Estos ascienden desde el cerebelo e ingresan en el mesencéfalo al nivel de los colículos inferiores.
- Las fibras se pueden encontrar en el centro de la porción ventral del tegmento mesencefálico.
Estos se bifurcan a nivel del colículo inferior (decusación de los pedúnculos cerebelosos superiores), conformando una comisura con forma de herradura, conocida como comisura de Wernekinck. Después de dicha decusación o bifurcación, las fibras se dividen en fascículos ascendentes y descendentes.
El fascículo ascendente está formado por el tracto cerebelotalámico y el tracto cerebelorubral. El primero de estos tractos continúa su recorrido a través del tronco encefálico hasta llegar al núcleo ventrolateral del tálamo, mientras que el segundo tracto hace sinapsis con el núcleo rojo contralateral. Una pequeña parte de las fibras ascendentes hace sinapsis con la sustancia gris central y la formación reticular. El fascículo descendente está conformado por fibras que hacen sinapsis con la formación reticular del puente y el bulbo raquídeo (también conocido como ‘medula oblongada’), así como con los núcleos olivares.
El mesencéfalo posee cinco vías sensoriales: un fascículo y cuatro lemniscos. Estos son el fascículo longitudinal medial, el lemnisco medial, el lemnisco trigeminal, el lemnisco espinal y el lemnisco lateral. El fascículo longitudinal medial se encuentra justo dorsal a la bifurcación del pedúnculo cerebeloso superior.
Esta vía conecta los núcleos oculomotor, troclear, abducens, Edinger-Westphal, vestibular, reticular y accesorio espinal. A través de estas comunicaciones permite los movimientos oculares conjugados, así como también los movimientos que están asociados con la cabeza y el cuello, Los cuatro lemniscos discurren por el margen lateral del tegmento.
De ventral a dorsal, se distribuyen de la siguiente manera:
Lemnisco medial: es una vía sensorial que continúa en la columna dorsal de la médula espinal, conformado a su vez, la vía de la columna dorsal-lemnisco medial. Este sistema sensorial se encarga de transmitir al tálamo la información sobre vibración, tacto leve, estiramiento de la piel, propiocepción, temperatura, cambios de textura, y presión. Lemnisco trigeminal (tracto trigeminotalámico) – lleva la sensación del tacto, de dolor y de la temperatura desde la cabeza hasta el tálamo Lemnisco espinal (tracto espinotalámico) – transmite al tálamo información sobre el dolor, la temperatura, el tacto no discriminativo y la presión. Lemnisco lateral: transmite la información auditiva del núcleo coclear al colículo inferior contralateral.
